L’équipe INSERM métabolisme, CAncer et REponses immunes (mCARE), créée en 2006, s’intéresse aux bases moléculaires du métabolisme énergétique dans les cancers (lymphomes et cancers du poumon).
Notre stratégie de recherche consiste à déterminer si la modulation du métabolisme des cellules cancéreuses et des enzymes métaboliques peut moduler la croissance tumorale, la réponse aux chimiothérapies et la réponse immunitaire anticancéreuse.

Dans la recherche sur le cancer, l'identification des spécificités des cellules tumorales par rapport aux cellules proliférantes « normales » est considérée comme le Saint Graal pour la mise en place des thérapies ciblées. Bien que d'origines diverses, la plupart des cellules cancéreuses partagent des caractéristiques communes telles que la capacité d'échapper à la mort cellulaire et l'utilisation de différentes sources d'énergie. Dans le paradigme actuel, la glycolyse aérobie est considérée comme la caractéristique métabolique centrale des cellules cancéreuses (effet Warburg). Cependant, des données récentes indiquent que des changements importants dans d'autres voies métaboliques sont également nécessaires, notamment le métabolisme des acides aminés, des lipides et des mitochondries (phosphorylation oxidative ou OxPhos). Dans ce tableau plus complexe, cette variété de source métabolique pourrait être une force (provoquant des possibilités infinies d'adaptation et de résistance aux médicaments) ou une faiblesse qui pourrait être ciblée pour éliminer les cellules cancéreuses.
Notre laboratoire étudie les bases moléculaires du métabolisme tumoral dans les cancers : comment peut-il être ciblé et comment il peut influencer la réponse immune anti-cancéreuse – dans un continuum allant des mécanismes fondamentaux à la clinique. Nous développons des modèles précliniques uniques et des méthodes in vivo pour étudier la dépendance métabolique des cellules tumorales tout en étant situées dans leur micro-environnement pathologique approprié.

Projets

JE. RicciDirecteur de recherche
Mail jean-ehrland.ricci@univ-cotedazur.fr

J. ChicheChargée de recherche
Mail Johanna.CHICHE@univ-cotedazur.fr
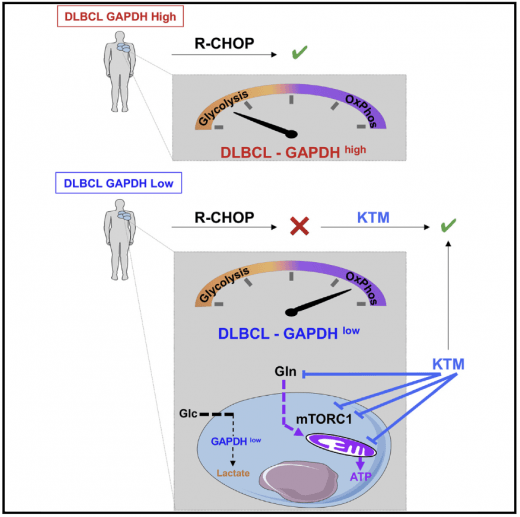
Environ 40 % des patients atteints de lymphome diffus à grandes cellules B (DLBCL) sont réfractaires au traitement de réference (R-CHOP). Le DLBCL est métaboliquement hétérogène. Nous avons montré que de faibles niveaux de GAPDH, qui prédisent une mauvaise réponse au R-CHOP, sont associés au métabolisme mitochondrial d'OxPhos, à la signalisation mTORC1 et à la glutaminolyse. Les inhibiteurs de ces voies métaboliques ont amélioré la réponse des souris et des patients présentant au diagnostique un DLBCL avec des niveaux faible de GAPDH. Chiche et al. Cell Metabolism 2019

R. Paul-BellonIngénieur(e) d’études
Mail Rachel.PAUL@univ-cotedazur.fr

S. MarchettiChargé de recherche
Mail Sandrine.MARCHETTI@univ-cotedazur.fr

A. AusselDoctorant(e)
Mail anais.aussel@etu.univ-cotedazur.fr

N. DoratIngénieur(e) d’études
Mail noemie.dorat@sfr.fr

E. ChicheChef(fe) de clinique des universités-assistant(e) des hôpitaux (CCA)
Mail chiche.e@chu-nice.fr

N. MounierProfesseur des Universités-Praticien hospitalier (PU-PH)
Mail mounier.n@chu-nice.fr

L. ZawilPostdoctorant(e)
Mail leenazaweel@gmail.com

JE. RicciDirecteur de recherche
Mail jean-ehrland.ricci@univ-cotedazur.fr
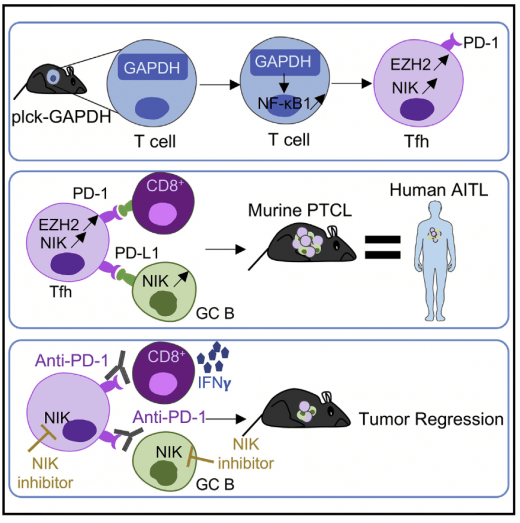
Nous avons généré des souris transgéniques surexprimant GAPDH dans les cellules T. Ces souris développent un lymphome qui récapitule les principales caractéristiques du lymphome angio-immunoblastique humain (AITL), y compris l'activation de la voie non canonique NF-kB. Le blocage de l'activité NF-kB avec un inhibiteur de NIK réduit la croissance de l'AITL chez l'homme et la souris. Mondragon et al. Cancer Cell 2019

R. Paul-BellonIngénieur(e) d’études
Mail Rachel.PAUL@univ-cotedazur.fr

JE. RicciDirecteur de recherche
Mail jean-ehrland.ricci@univ-cotedazur.fr
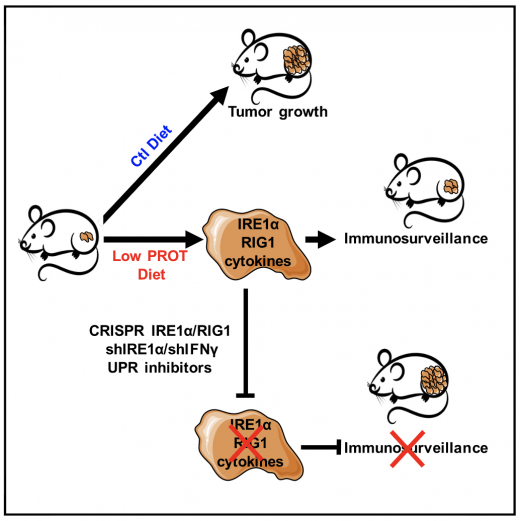
La restriction alimentaire (RD) ralentit la croissance tumorale en augmentant l'immunosurveillance tumorale. Nous avons montré qu'une réduction modérée de l'apport alimentaire en protéines, plutôt qu'une réduction des glucides, active la voie IRE1a/RIG1 dans les cellules tumorales, entraînant une réponse immunitaire anticancéreuse chez la souris. Rubio-Patino et al. Cell Metabolism 2018

H. IssaouiPostdoctorant(e)
Mail hussein_issaoui1992@hotmail.fr

R. Paul-BellonIngénieur(e) d’études
Mail Rachel.PAUL@univ-cotedazur.fr

S. MarchettiChargé de recherche
Mail Sandrine.MARCHETTI@univ-cotedazur.fr

J. ChicheChargée de recherche
Mail Johanna.CHICHE@univ-cotedazur.fr

JE. RicciDirecteur de recherche
Mail jean-ehrland.ricci@univ-cotedazur.fr

S. MarchettiChargé de recherche
Mail Sandrine.MARCHETTI@univ-cotedazur.fr
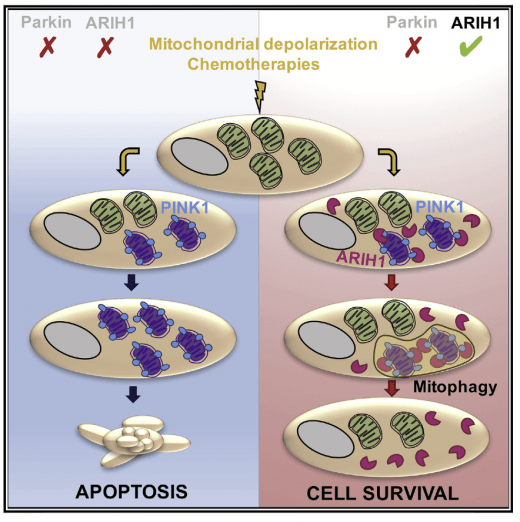
La clairance des mitochondries endommagées (mitophagie) est impliquée dans la résistance à la mort induite par la chimiothérapie, mais les principaux régulateurs connus de la mitophagie ne sont pas exprimés dans les cellules cancéreuses. Nous avons établit que la RBR E3 ligase ARIH1 est exprimée dans plusieurs types de cellules cancéreuses. ARIH1 contrôle la mitophagie dépendante de PINK1 et sensibilité les cellules tumorales aux chimiothérapies. Villa et al. Cell Reports 2017

S. Nunez-VasquezPostdoctorant(e)
Mail nunezvazquez.sonia@gmail.com

R. Paul-BellonIngénieur(e) d’études
Mail Rachel.PAUL@univ-cotedazur.fr

J. ChicheChargée de recherche
Mail Johanna.CHICHE@univ-cotedazur.fr

D. GoncalvesDoctorant(e)
Mail diogo.jumel-goncalves@etu.univ-cotedazur.fr

L. Di-MascioIngénieur(e) d’études
Mail Lea.Di-Mascio@unice.fr
Publications
Focus
GAPDH Expression Predicts the Response to R-CHOP, the Tumor Metabolic Status, and the Response of DLBCL Patients to Metabolic Inhibitors.Auteurs Chiche J, Reverso-Meinietti J, Mouchotte A, Rubio-Patiño C, Mhaidly R, Villa E, Bossowski JP, Proics E, Grima-Reyes M, Paquet A, Fragaki K, Marchetti S, Briere J, Ambrosetti D, Michiels JF, Molina TJ, Copie-Bergman C, Lehmann-Che J, Peyrottes I, Peyrade F, de Kerviler E, Taillan B, Garnier G, Verhoeyen E, Paquis-Flucklinger V, Shintu L, Delwail V, Delpech-Debiais C, Delarue R, Bosly A, Petrella T, Brisou G, Nadel B, Barbry P, Mounier N, Thieblemont C, Ricci JE
Cell metabolism Juin 2019
D'autres publications récentes
In vivo CAR T cell therapy against angioimmunoblastic T cell lymphoma.Auteurs Krug A, Saidane A, Martinello C, Fusil F, Michels A, Buchholz CJ, Ricci JE, Verhoeyen E
Journal of experimental & clinical cancer research : CR Sep 2024
Dependence on mitochondrial respiration of malignant T cells reveals a new therapeutic target for angioimmunoblastic T-cell lymphoma.Auteurs Krug A, Mhaidly R, Tosolini M, Mondragon L, Tari G, Turtos AM, Paul-Bellon R, Asnafi V, Marchetti S, Di Mascio L, Travert M, Bost F, Bachy E, Argüello RJ, Fournié JJ, Gaulard P, Lemonnier F, Ricci JE, Verhoeyen E
Cell death discovery Jun 2024
Bax Inhibitor-1 preserves pancreatic β-cell proteostasis by limiting proinsulin misfolding and programmed cell death.Auteurs Blanc M, Habbouche L, Xiao P, Lebeaupin C, Janona M, Vaillant N, Irondelle M, Gilleron J, Murcy F, Rousseau D, Luci C, Barouillet T, Marchetti S, Lacas-Gervais S, Yvan-Charvet L, Gual P, Cardozo AK, Bailly-Maitre B
Cell death & disease May 2024
Voir toutes les publicationsBrevets
Co-inventeurs J. Chiche, J. Ricci, catherine Thieblemont
Co-inventeurs J. Chiche, J. Ricci, catherine Thieblemont
Co-inventeurs J. Chiche, J. Ricci, catherine Thieblemont


