Le cancer de la prostate est le cancer le plus fréquent chez l'homme et constitue la troisième cause de mortalité par cancer. Les problèmes majeurs de ce cancer sont l'absence de marqueur d'agressivité et la résistance aux traitements. En effet, il n'existe actuellement aucun marqueur permettant de prédire l'agressivité de ce cancer qui tue plus de 8000 personnes par an en France. Notre laboratoire s'intéresse à l'étude des mécanismes moléculaires et cellulaires impliqués dans la formation des métastases et la résistance aux traitements.
Le destin des cellules tumorales dépend de leur microenvironnement et de leur exposition à des facteurs environnementaux. Plus généralement, les cellules cancéreuses s'adaptent à leur écosystème complexe pour maintenir leur prolifération et leur dissémination. Cette adaptation nécessite la régulation de voies métaboliques qui favorisent la survie cellulaire, la motilité, l'invasivité et l'angiogenèse tumorale. Ces capacités impliquent des communications actives entre les cellules tumorales et leur environnement régulé par des variables physico-chimiques : nutriments, concentration en oxygène (hypoxie), hormones, et pH. Notre projet d'équipe englobe l'étude du métabolisme des cellules cancéreuses ainsi que l'interférence des perturbateurs endocriniens sur la progression du cancer.

Projets

F. BOSTDirecteur de recherche
Mail frederic.bost@univ-cotedazur.fr
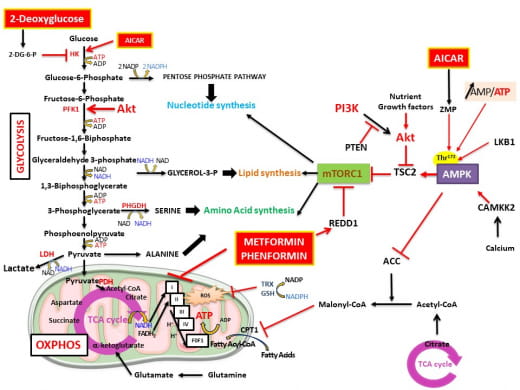
Les cellules cancéreuses ont un métabolisme différent des cellules normales. Elles reprogramment leur métabolisme pour répondre aux demandes bioénergétiques et biosynthétiques dans le but de proliférer et envahir les tissus environnants. Plusieurs études ont montré que des agents perturbateurs du métabolisme peuvent ralentir la croissance tumorale. Notre équipe fût une des premières à démontrer que la metformine, un médicament initialement prescrit contre le diabète de type 2, cible le métabolisme mitochondrial et induit un stress énergétique dans les cellules cancéreuses de prostate. Nous avons montré que la metformine ralentit la croissance tumorale et diminue de façon significative la formation de métastase. Plus récemment, nous avons montré que PGC-1 alpha un co-activateur de facteur de transcription régule la synthèse des polyamines et l’agressivité des cellules tumorales. Notre projet de recherche consiste à mieux comprendre comment, en interférant avec le métabolisme cellulaire, nous pouvons cibler la cellule cancéreuse de prostate afin d’identifier de nouvelles cibles thérapeutiques.

F. BOSTDirecteur de recherche
Mail frederic.bost@univ-cotedazur.fr

P. PeraldiChargé de recherche
Mail Pascal.Peraldi@unice.fr

M. KahiDoctorant(e)
Mail Michel.KAHI@univ-cotedazur.fr

A. MazzuIngénieur(e) d’études
Mail Abigail.Mazzu@unice.fr
JM. FerreroProfesseur des Universités-Praticien hospitalier (PU-PH)
Mail jean-marc.ferrero@nice.unicancer.fr

M. Pujalte-MartinDoctorant(e)
Mail Marc.PUJALTE-MARTIN@nice.unicancer.fr

N. MazureDirectrice de recherche
Mail nathalie.mazure@univ-cotedazur.fr
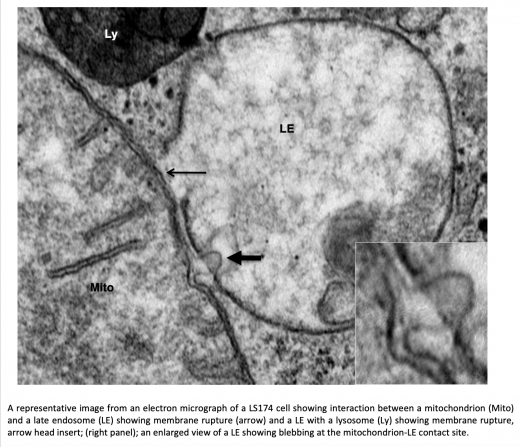
Notre équipe a identifié un mécanisme moléculaire nouveau et convaincant dépendant du facteur inductible de l'hypoxie (HIF) et de TP53/TP73 qui implique un contact direct entre les mitochondries et les endolysosomes dans les cellules cancéreuses (cancers du sein, du côlon, du rein et du poumon). Ce contact croisé implique des mitochondries agrandies, présentant un remodelage des crêtes mitochondriales, et la troncature du canal anionique mitochondrial voltage-dépendant C-terminal (VDAC1 à VDAC1-ΔC) par des peptidases lysosomales (Legumain-LGM). Il en résulte une régulation métabolique plus importante (à la fois de la phosphorylation oxydative (OXPHOS) et de la glycolyse) et une résistance accrue à la chimiothérapie. Avec ses trois isoformes, VDAC1, 2 et 3, la famille des canaux constitue les protéines formant des pores les plus abondantes dans la membrane externe mitochondriale (MOM) où elles contrôlent le flux d'ADP, d'ATP, d'ions, de substrats respiratoires et de métabolites à travers l'organite. En se liant à VDAC, plusieurs protéines cytoplasmiques et cytosquelettiques, dont la tubuline, modulent la perméabilité de la MOM et contrôlent ainsi une grande variété de fonctions mitochondriales et probablement la réponse à la chimiothérapie. Une expression ou une fonction aberrante de VDAC a été signalée dans de nombreuses tumeurs, ce qui indique que le ciblage de VDAC revêt une importance thérapeutique pour le traitement du cancer.
Nous avons montré que la forme clivée de VDAC1 induite par l'hypoxie (c'est-à-dire VDAC1-ΔC) est un régulateur critique de la glycolyse et de la ciliogenèse, car la conversion de VDAC1 en VDAC1-ΔC est corrélée à la perte de cil primaire (PC) et à l'augmentation de la glycolyse et de la respiration mitochondriale. Nos études démontrent que VDAC1-ΔC reprogramme les cellules déficientes en PC pour qu'elles utilisent plus de métabolites (i.e. lactate, mannitol, fructose ...) favorisant la croissance cellulaire dans un microenvironnement hypoxique.

N. MazureDirectrice de recherche
Mail nathalie.mazure@univ-cotedazur.fr

Y. GuoDoctorant(e)
Mail yingbo.guo@etu.univ-cotedazur.fr

S. PengDoctorant(e)
Mail siyong.peng@etu.univ-evry.fr

A. MazzuIngénieur(e) d’études
Mail Abigail.Mazzu@unice.fr

C. HinaultMaitre de conférence-Praticien(ne) hospitalier (MCU-PH)
Mail Charlotte.Hinault@unice.fr

N. ChevalierProfesseur des Universités-Praticien hospitalier (PU-PH)
Mail Nicolas.Chevalier@unice.f
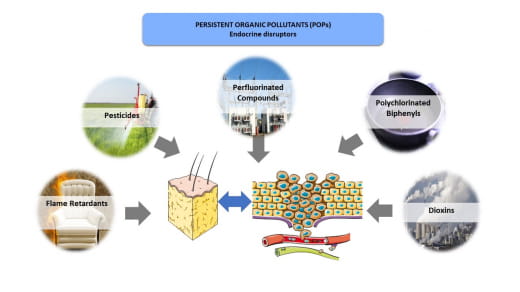
Les perturbateurs endocriniens (PE) constituent une catégorie hétérogène de polluants environnementaux principalement issus de l'industrie chimique : pesticides, plastiques, produits pharmaceutiques, peintures, colles, etc. Parmi les PE, les polluants organiques persistants (POP) sont une source majeure de préoccupation pour la santé humaine ; ils sont persistants dans l'environnement pendant plusieurs décennies et, en raison de leur nature lipophile, ils sont bio-accumulatifs dans les organismes (notamment dans le tissu adipeux : TA). Si l'AT joue initialement un rôle protecteur en stockant ces EDC, ces derniers peuvent provoquer une modification du sécrétome adipeux, et être libérés dans l'organisme, notamment après une perte de poids. Ces modifications peuvent avoir un impact négatif sur l'organisme, sur le développement de certains cancers hormono-sensibles, bien au-delà de la période d'exposition initiale. Notre objectif global est de caractériser les modifications induites par les EDC sur le sécrétome adipeux, et de déterminer leur impact sur la prolifération des cellules de la prostate. Les POP sont classés en cinq catégories : les dibenzoparadioxines polychlorées (PCDD) et les dibenzofuranes polychlorés (PCBF), les biphényles polychlorés (PCB), les pesticides organochlorés (OC) (interdits depuis 1970 en raison de leur toxicité), les retardateurs de flamme polybromés (PBDE) et les dérivés du perfluorooctane (PFOS et PFOA) présents dans les revêtements anti-adhésifs. Certains de ces POP ayant une activité hormono-mimétique, le CIRC (Centre international de recherche sur le cancer) a suggéré un rôle très probable de l'exposition à ces POP dans l'apparition et le développement de cancers hormono-sensibles : thyroïde, prostate, testicule, sein, ovaire. Cependant, le danger exact de l'exposition aux POPs reste difficile à estimer et à quantifier.

C. HinaultMaitre de conférence-Praticien(ne) hospitalier (MCU-PH)
Mail Charlotte.Hinault@unice.fr

N. ChevalierProfesseur des Universités-Praticien hospitalier (PU-PH)
Mail Nicolas.Chevalier@unice.f

F. BOSTDirecteur de recherche
Mail frederic.bost@univ-cotedazur.fr
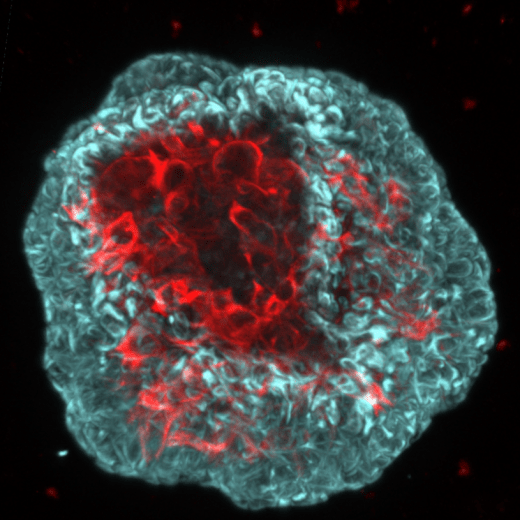
L’immense majorité des molécules « anti-cancer » validées en laboratoire, se révèlent inefficaces lors d’essais cliniques. Ce constat dramatique est lié au manque de pertinence des modèles expérimentaux utilisés en recherche (murins et lignées cellulaires). Par exemple, les modèles de souris génétiquement modifiées ne reflètent pas la complexité histologique et l'hétérogénéité génétique des cancers humains. Le développement spectaculaire des technologies de culture cellulaire en 3D et l’obtention, à partir de cellules progénitrices ou de « cellules souches tumorales » humaines de structures organotypiques auto-organisatrices : organoïdes/tumoroïdes, sont en passe de révolutionner la médecine translationnelle. L’objectif de la "médecine de précision" est de délivrer à chaque patient un traitement spécifique qui peut être testé « a priori » sur les cellules tumorales issues de sa propre tumeur. Dans cette optique, nous avons mis au point au laboratoire, la production et la culture d’organoïdes/tumoroïdes issus de cellules de patients atteints de cancer de la prostate. Cette stratégie nous permet, à partir de pièces chirurgicales fraîches, d’obtenir pour chaque patient, des populations d’organoïdes (zones saines) et de tumoroïdes (zones cancéreuses).

J. MurdacaIngénieur(e) d’études
Mail Joseph.MURDACA@univ-cotedazur.fr

7th Yamada Symposium
Du 25 au 30 Août 2024 - Kobe (Japon)
https://smartconf.jp/content/icbrp2024/


Du 16 au 18 décembre 2024 - Le Croisic (France)
Publications
YAP1 modulation of primary cilia-mediated ciliogenesis in 2D and 3D prostate cancer models.Auteurs Guo Y, Dupart M, Irondelle M, Peraldi P, Bost F, Mazure NM
FEBS letters Oct 2024
Publisher Correction: LKB1-SIK2 loss drives uveal melanoma proliferation and hypersensitivity to SLC8A1 and ROS inhibition.Auteurs Proteau S, Krossa I, Husser C, Guéguinou M, Sella F, Bille K, Irondelle M, Dalmasso M, Barouillet T, Cheli Y, Pisibon C, Arrighi N, Nahon-Estève S, Martel A, Gastaud L, Lassalle S, Mignen O, Brest P, Mazure NM, Bost F, Baillif S, Landreville S, Turcotte S, Hasson D, Carcamo S, Vandier C, Bernstein E, Yvan-Charvet L, Levesque MP, Ballotti R, Bertolotto C, Strub T
EMBO molecular medicine Aug 2024
Vitiligo auto-immune response upon oxidative stress-related mitochondrial DNA release opens up new therapeutic strategies.Auteurs Sant'Anna-Silva ACB, Botton T, Rossi A, Dobner J, Bzioueche H, Thach N, Blot L, Pagnotta S, Kleszczynski K, Steinbrink K, Mazure NM, Rocchi S, Krutmann J, Passeron T, Tulic MK
Clinical and translational medicine Aug 2024
Voir toutes les publicationsBrevets
Co-inventeurs N. Mazure, Lucilla Fabbri Maeva Dufies
Co-inventeurs N. Mazure, Lucilla Fabbri Maeva Dufies






