L'équipe "DysHéma" étudie les mécanismes moléculaires qui conduisent à la transformation maligne dans les hémopathies humaines afin d'identifier de nouvelles cibles moléculaires et des molécules actives qui définiront des stratégies thérapeutiques innovantes. Nous nous sommes particulièrement intéressés à la Leucémie Aiguë Myéloïde (LAM) et à la Leucémie Aiguë Lymphoblastique T (LAL-T) de l'enfant, deux leucémies qui, malgré des décennies d'amélioration des traitements, ont toujours une issue médiocre pour les patients en rechute.
L'équipe mène une recherche fondamentale et translationnelle en partenariat avec le service d'oncologie pédiatrique du CHU de Nice. Outre notre longue expérience en biochimie et en biologie cellulaire et moléculaire, nous avons mis en place des collaborations avec des chimistes et des biochimistes en cryo-microscopie électronique (cryo-EM) et développé des approches bio-informatiques pour atteindre nos objectifs :
- identifier et étudier les événements dérégulés impliqués dans les addictions et les résistances moléculaires
- analyser les propriétés pathologiques des cellules souches leucémiques qui génèrent la leucémie, entretiennent la maladie, puis déclenchent l'échec thérapeutique et la rechute.


Projets

JF. PEYRONDirecteur de recherche
Mail Jean-Francois.PEYRON@univ-cotedazur.fr
Les cellules cancéreuses reprogramment leurs voies métaboliques afin d’optimiser les apports en nutriments et en énergie nécessaires à leur prolifération exacerbée, à l’échappement à l’apoptose et à la résistance aux traitements. Le ciblage de leur métabolisme dérégulé permet d’élaborer de nouvelles stratégies anti-tumorales.
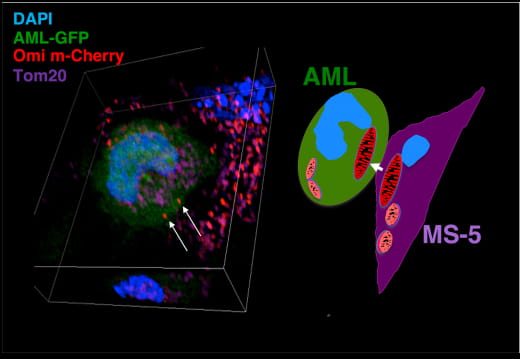
Reconstruction 3D de microscopie confocale d'une coculture AML-GFP avec les cellules stromales MS5-Omi-MCherry.
Comarquage des mitochondries avec anti-Tom20.
Le microenvironnement de la moelle osseuse (BMME) est un écosystème complexe qui instruit et protège les cellules souches hématopoïétiques (CSH) et leurs homologues malignes, les cellules souches leucémiques/cellules initiatrices de leucémie CSL/LIC. Parmi les différents échanges fonctionnels qui ont lieu dans la BMME, le transfert d'organelles apparaît comme un nouveau mode de communication intercellulaire important, à côté du rôle des molécules d'adhésion, des cytokines sécrétées, des (onco)métabolites.
En utilisant un modèle de coculture mimant la niche hématopoiétique, nous avons mis en évidence que les cellules de Leucémie Aiguë Myéloide (LAM) soumises à un stress chimiothérapeutique déclenchent un transfert unidirectionnel de mitochondries actives provenant des cellules stromales mésenchymateuses. Cet apport de mitochondries augmente leur masse et leur aptitude mitochondriale, accroît leur potentiel d'initiation de culture leucémique à long terme ainsi que leur résistance à la chimiothérapie.
Cibler ce transfert mitochondrial qui fournit un avantage de survie aux cellules leucémiques pourrait représenter une nouvelle stratégie pour interférer avec les actions de soutien de la BMME pendant la progression de la leucémie et la rechute.
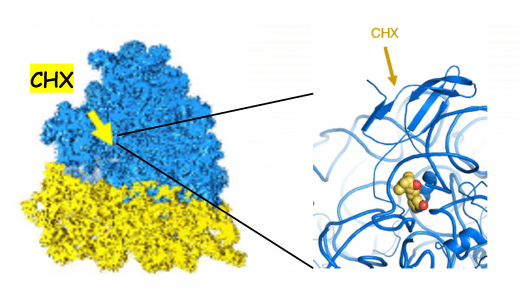
Première structure cryo-EM d'un complexe CHX/80S
Résolution moyenne : 3,6 Å
A partir de la connaissance des interactions atomiques à haute résolution de l'inhibiteur de synthèse protéique cycloheximide (CHX) avec le ribosome 80S humain nous avons créé en 2017 un consortium de trois équipes : le laboratoire de biochimie de Bruno Klaholz (IGBMC, Illkirch) pour les structures cryo-EM, le laboratoire de Jean-Yves Winum (Institut des Biomolécules Max Mousseron, Montpellier) pour la chimie organique et médicinale et le laboratoire de J-F Peyron (C3M, Nice) pour la caractérisation fonctionnelle in vitro et in vivo de molécules anticancéreuses. Nous avons lancé une stratégie de drug-design utilisant la connaissance de la structure CHX-80S pour synthétiser des dérivés de CHX plus efficaces et sélectifs, ayant des propriétés anti-leucémiques. Ces nouveaux dérivés sont en cours de caractérisation in vitro : effets anti-leucémiques vis à vis de lignées humaines et murines de L/LAL-T, toxicité vis à vis de cellules saines. Une sélection des molécules les plus efficaces et les moins toxiques sera testéee dans un modèle LAL-T-PDX (Patient-derived Tumor Xenografts).
Ce projet est soutenu par l’InCa (PLBIO 2016 et 2021).

V. ImbertChargée de recherche
Mail veronique.imbert@univ-cotedazur.fr

M. NEBOUTIngénieur(e) d’études
Mail nebout@unice.fr

C. DuranoIngénieur(e) d’études
Mail celia.durano@univ-cotedazur.fr

D. MARYChargé de recherche
Mail Didier.MARY@univ-cotedazur.fr
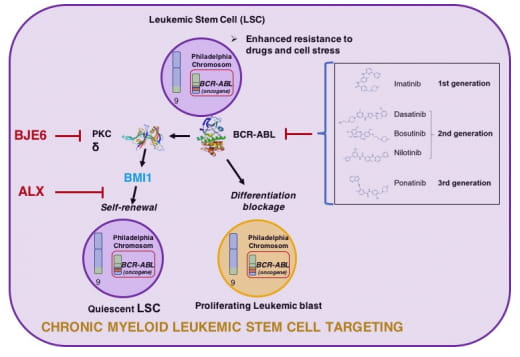
L’extinction de BMI1 par ARN interférence est délétère dans un grand nombre de cancers cependant la possibilité d’induire une telle réponse avec des moyens pharmacologiques reste très limitée. Il n’existe à ce jour aucune molécule ayant réussi les phases d’essais cliniques pour cibler directement BMI1.
Dans un premier axe nous avons développé une stratégie pour agir « en aval » de la protéine polycomb Bmi1, cruciale pour la fonction d’auto-renouvellement des cellules souches normales ou cancéreuses, par une approche bio-informatique utilisant la base de données Connectivity Map (cmap). Ceci nous a permis d’identifier des molécules appartenant à la famille des bis-biguanides dont certaines se sont révélées avoir un fort potentiel anti-tumoral sur des lignées de Leucémie Myéloide Chronique LMC. Plus intéressant encore, ces bis-biguanides potentialisent les effets des inhibiteurs de BCR-ABL (ITKs) aussi sur les cellules sensibles que sur les cellules pourtant résistantes à ces inhibiteurs.
Dans un deuxième axe nous avons montré l’implication de la PKC delta dans la voie de signalisation entre BCR-ABL et la régulation de l’expression du gène de BMI1. Dans une collaboration avec une équipe américaine spécialiste de la synthèse d’inhibiteurs de kinase, nous avons utilisé un inhibiteur spécifique de PKC delta (BJE6) et montré sa capacité à potentialisre l’effet des ITK et cibler le compartiment souche leucémique dans des systèmes de co-cultures sur cellules stromales.
Ce projet a reçu un financement FiLMC-Pfizer et Cancéropôle PACA.

M. NEBOUTIngénieur(e) d’études
Mail nebout@unice.fr

V. ImbertChargée de recherche
Mail veronique.imbert@univ-cotedazur.fr
NF-κB est un facteur de transcription qui contrôle de multiples processus cellulaires essentiels pour l’immunité, l’inflammation, le développement des tumeurs, la chimiorésistance et la radiorésistance. Notre équipe a largement contribué à la mise en évidence de ce rôle pro-tumoral de NF-κB.
Nous disposons d’un modèle in vivo représentatif des Lymphomes et Leucémies Lymphoblastiques T Aiguës humaines (LL-T/LAL-T), généré par délétion du gène suppresseur de tumeur PTEN spécifiquement dans les cellules T (tPTEN-/-). L'absence de PTEN conduit à une activation constitutive anormale de l'axe PI3K-Akt-mTOR, une caractéristique trouvée à haute fréquence dans la pathologie humaine. Lors de la caractérisation des voies de signalisation dérégulées dans ce modèle tPTEN-/-, nous avons observé une activation constitutive de NF-κB. Afin de mieux comprendre son rôle dans l’initiation et la progression du lymphome, nous avons adopté une approche génétique. Ainsi l'invalidation de NF-κB dans le modèle tPTEN-/- nous a permis d’observer un rôle suppresseur de tumeurs pour NF-κB au cours de la mise en place du lymphome. Actuellement, nous étudions ce rôle à différents niveaux : réponse anti-tumorale, stabilité génique.
Ce projet est soutenu par la Fondation ARC.

M. NEBOUTIngénieur(e) d’études
Mail nebout@unice.fr
Publications
Focus
Structure-function insights reveal the human ribosome as a cancer target for antibiotics.Auteurs Myasnikov AG, Kundhavai Natchiar S, Nebout M, Hazemann I, Imbert V, Khatter H, Peyron JF, Klaholz BP
Nature communications Sep 2016
Identifying Candidate Gene Drivers Associated with Relapse in Pediatric T-Cell Acute Lymphoblastic Leukemia Using a Gene Co-Expression Network Approach.Auteurs Kypraios A, Bennour J, Imbert V, David L, Calvo J, Pflumio F, Bonnet R, Couralet M, Magnone V, Lebrigand K, Barbry P, Rohrlich PS, Peyron JF
Cancers May 2024
D'autres publications récentes
High CD44 expression and enhanced E-selectin binding identified as biomarkers of chemoresistant leukemic cells in human T-ALL.Auteurs Calvo J, Naguibneva I, Kypraios A, Gilain F, Uzan B, Gaillard B, Bellenger L, Renou L, Antoniewski C, Lapillonne H, Petit A, Ballerini P, Mancini SJ, Marchand T, Peyron JF, Pflumio F
Leukemia Nov 2024
Identifying Candidate Gene Drivers Associated with Relapse in Pediatric T-Cell Acute Lymphoblastic Leukemia Using a Gene Co-Expression Network Approach.Auteurs Kypraios A, Bennour J, Imbert V, David L, Calvo J, Pflumio F, Bonnet R, Couralet M, Magnone V, Lebrigand K, Barbry P, Rohrlich PS, Peyron JF
Cancers May 2024
Oxidative phosphorylation fueled by fatty acid oxidation sensitizes leukemic stem cells to cold.Auteurs Griessinger E, Pereira-Martins D, Nebout M, Bosc C, Saland E, Boet E, Sahal A, Chiche J, Debayle D, Fleuriot L, Pruis M, Mansat-De Mas V, Vergez F, Récher C, Huls G, Sarry JE, Schuringa JJ, Peyron JF
Cancer research Jun 2023
Voir toutes les publicationsBrevets
Co-inventeurs J. PEYRON
Co-inventeurs J. PEYRON
Journée Donateurs ARC, Mai 2017

REVUE DE PRESSE






